Teorija
Definicija električne prevodnosti
Električna upornost R je fizikalna količina, ki po Ohmovem zakonu določa razmerje med električno napetostjo U na uporniku in električnim tokom I, ki teče skozenj. Specifična upornost ρ pa je določena kot razmerje med dolžino upornika ter produktom njegove upornostji in preseka(pravokotnega glede na smer el. toka skozenj).
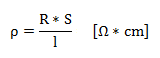
R [Ω] - upornost, S [cm2] - površina, l [cm] - dolžina
Njej recipročna količina je specifična prevodnost σ:
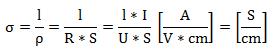
Tukaj se ponavadi uporablja enota Siemens [S], ki je recipročna enoti Ohm. (1 S = 1 Ω-1)
Ta količina nam da nek kvantitativen podatek o tem, kako močan prevodnik je neka snov za električni tok.
Zakaj je nekaj prevodno?
Prevajanje toka v katerikoli snovi se vrši preko prostih ionov ali elektronov. Najenostavnejši primer so kovine, ki imajo veliko prostih elektronov. V kapljevinah pa so za prevodnost električnega toka krivi prosti ioni.
Prevodnost je odvisna od količine prenešenega naboja (koncentracije ionov, hitrosti gibanja ter njihove valence). Elektroliti so snovi, ki v raztopninah disociirajo na ione, ki se delijo na katione (nosilce pozitivnega naboja) ter anione (nosilce negativnega naboja). Destilirana voda toka skoraj ne prevaja, saj vsebuje le majhno koncentracijo oksonijevih (H+) in hidroksidnih (OH-) ionov.
Temperaturna odvisnost
Prevodnost se povečuje tudi s temperaturo, ker elektroliti pri višji temperaturi bolje disociirajo. Zaradi tega je pomembno pri merjenju prevodnosti neke snovi vzdrževati stalno temperaturo. Da so rezultati primerljivi med sabo, po dogovoru podamo pri rezultatih prevodnost, kakršna bi bila pri 25°C. Zaradi enostavnosti se standardno upošteva, da se za vsako stopinjo razlike, prevodnost spremeni za 2% od prevodnosti pri 25°C.
V primeru vode, torej:
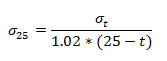
Prevodnost pri različnih koncenctracijah
Eden najmočnejših elektrolitov je NaCl ali po domače sol, ki se v vodi raztopi v pozitivni natrijev (Na+), ter negativni klorov ion (Cl-). Sladkor, po drugi strani, se prav tako raztopi v vodi, a ne tvori nobenih ionov in posledično ni elektrolit. Efekt pri soli je dovolj močan, da je zelo praktično meriti količino soli v vodi, torej slanost vode ravno preko prevodnosti.
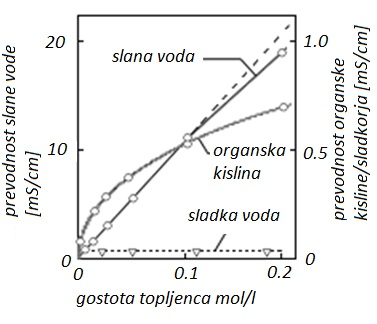 Slika 1: Naraščanje prevodnosti s koncentracijo soli v vodi
Slika 1: Naraščanje prevodnosti s koncentracijo soli v vodi
Pri nizkih koncentracijah močnih elektrilitov (snovi z visoko stopnko disociacije) specifična prevodnost kapljevin narašča linearno z koncentracijo raztopnine. Pri visokih koncentracijah pa naraščanje ni več linearno, saj se pri višji koncentraciji ionov povprečna razdalja med njimi zmanjšuje, kar privede do interakcij med njimi. Ioni nasprotnoimenskih nabojev zaradi privlačnih sil asociirajo in tvorijo kristale (ali molekule), ki so navzven nevtralni (brez naboja) in zato ne prevajajo toka.
Viri
- M. Drofenik: Splošna in anorganska kemija
- M. Stratmann, G. Frankel: Encyclopedia of Electrochemistry, volume4: Corrosion and Oxide Films
- R. Holze: Experimental Electrochemistry
- Slika 1: http://www.horiba.com/scientific/service-support/application-center/ph-meter-faq/the-story-of-conductivity/the-fundamentals/ions-in-water-and-conductivity/