Teorija
ANOMALIJA VODE
Anomalija vode je posebnost vode, da ima največjo gostoto pri temperaturi 4 °C, kjer je gostota 1000 kg/m3. Pri segrevanju od 4 °C do vrelišča pri 100 °C se voda obnaša "normalno" saj se gostota vode zmanjšuje, pri segrevanju od 0 °C do 4 °C pa se gostota vode povečuje, kar pri ostalih snoveh ni značilno, saj je znano, da se gostota snovi s segrevanjem zmanjšuje.
Do pojava anomalije prihaja pri vodi zaradi močnih orientacijskih in vodikovih vezi med molekulami vode. Pri 4 °C se molekule vode začnejo organizirati v strukturo, ki se dokončno oblikuje pri 0 °C, ko voda zmrzne in nastane led. V tej strukturi so med molekulami vode praznine, zato je gostota ledu manjša od gostote vode (9 %) in led plava na vodi.
VODIKOVA VEZ
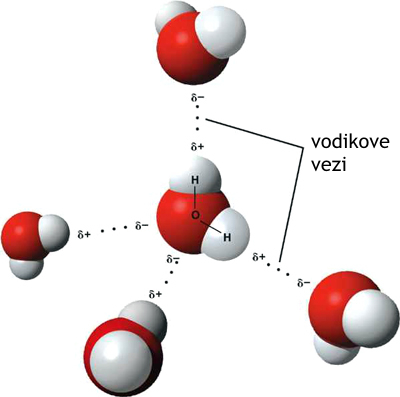
Vodikova vez je šibka kemijska vez, ki nastane v nekaterih spojinah, ki vsebujejo vodik, vezan na elektronegativen atom (O-H ali N-H skupino). Če vodik leži med dvema močno elektronegativnima elementoma, je z enim povezan s kovalentno polarno vezjo, z drugim pa z vodikovo vezjo.
Ko je prisotno več molekul, kot je to v primeru tekoče vode, je možnih več vezi, ker ima kisik ene molekule vode dva prosta elektronska para, od katerih lahko vsak tvori vodikove vezi z vodikom druge vodne molekule. To se lahko ponovi tako, da je vsaka molekula vode H-vezana z do štirimi drugimi molekulami, kot je prikazano na sliki 1. Število vodikovih vezi, ki so nastale med molekulami vode, se spreminja s časom in je odvisno od temperature. Pri višjih temperaturah je število vezi manjše kot pri nižjih.
Vodikova vez je najmočnejša izmed medmolekulskih vezi. Povzroča, da pride do anomalij v sicer pričakovanih lastnostih spojin, pri katerih nastopa ta vrsta vezi, na primer zvišano vrelišče. Primeri nastopa vezi so voda, amonijak, vodikov fluorid, zmes alkohola in vode.
PRIMERI
Anomalija vode omogoča življenje v vodi v zimskem času, ko se pozimi ozračje ohlaja in z njim tudi voda. Ohlajevanje poteka počasi, saj ima voda veliko toplotno vsebnost (kapaciteto). Ko se voda na površju ohladi na 4 °C postane najgostejša in potuje na dno (morja, jezera, mlake), na površje pa pride toplejša voda, ki se ohlaja. Ko je vsa voda ohlajena na 4 °C, se začne voda pri vrhu ohlajati in zmrzovati, saj se njena gostota manjša. In tako najprej na površini nastane led, ki pa je dober izolator in preprečuje prehitro ohlajevanje vode proti dnu.
Led ima večjo prostornino kot enaka masa vode, zato plava na vodi in to tako, da iz vode gleda 9 % ledene gmote, večina ledu pa je pod vodo. Velik del površine Antarktike in Arktike je na ledenih skladih. Ledene gore se spomladi trgajo iz zaledenelih obal in potujejo s toplejšimi tokovi, pri čemer pomenijo stalno nevarnost za ladijski transport, a obenem tudi možnost za pridobivanje pitne vode, kar je ugodno.
KAKO IZMERITI ANOMALIJO?
Pri nalogi smo izhajali iz enačbe:
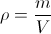 , ,
kjer je ρ gostota, m masa vode in V volumen vode. Pri konstantni masi, smo ohlajali oz. segrevali vodo. Ker je gostota vode pri različnih temperaturah različna, se s tem spreminja tudi njen volumen. Spremembe volumnov so zelo majhne, zato smo v osnovi segrevali oz. ohlajali relativno velik volumen (~400 mL), spremembe volumna pa smo merili posredno preko sprememb višine vodnega stolpca (∆h) v cevki z majhnim premerom (d = 2 mm). Pričakovano spremembo smo izračunali tako, da smo odvajali zgornjo enačbo in dobili:
.png) , ,
kjer je dh(T) sprememba višine vodnega stolpca v merilni cevki v odvisnosti od temperature T, ∆ρ sprememba gostote vode, V volumen vode, m masa vode in S presek merilne cevke (π r2, kjer je r radij cevke). Tako smo izračunali, da je ∆h, če vodo segrejmo od 0 °C do 4 °C, približno 1,7 cm.
Reference:
|